Din cuprinsul articolului
Comitetul pentru evaluarea riscurilor în materie de farmacovigilenţă (PRAC) al Agenţiei Europene a Medicamentului (EMA) a emis recent o atenționare cu privire la riscul de leziuni hepatice asociate unui medicament utilizat pentru tratarea bufeurilor și altor simptome ale menopauzei. În această atenționare, PRAC recomandă profesioniștilor din domeniul sănătății să monitorizeze cu atenție funcția hepatică a pacientelor atât înainte, cât și în timpul tratamentului cu acest medicament.
Aceste măsuri sunt menite să reducă riscurile de apariție a leziunilor hepatice și să asigure siguranța pacientelor care urmează tratamente pentru simptomele menopauzei.
Comitetul pentru evaluarea riscurilor în materie de farmacovigilenţă (PRAC) al EMA este responsabil cu evaluarea şi monitorizarea siguranţei medicamentelor de uz uman.
ALERTĂ: Medicamentul Veoza (fezolinetant)
În ultima şedinţă, din 25-28 noiembrie, experţii din cadrul PRAC au făcut noi recomandări pentru minimizarea riscului de leziuni hepatice în legătură cu medicamentul Veoza (fezolinetant), utilizat pentru tratarea simptomelor vasomotorii moderate până la severe (denumite şi bufeuri sau transpiraţii nocturne) asociate cu menopauza.
Comitetul a luat în considerare o revizuire a riscului potenţial al fezolinetantului de a provoca leziuni hepatice induse de medicament, pe baza informaţiilor din toate sursele disponibile, inclusiv rapoartele privind efectele secundare suspectate şi studiile publicate în literatura ştiinţifică.
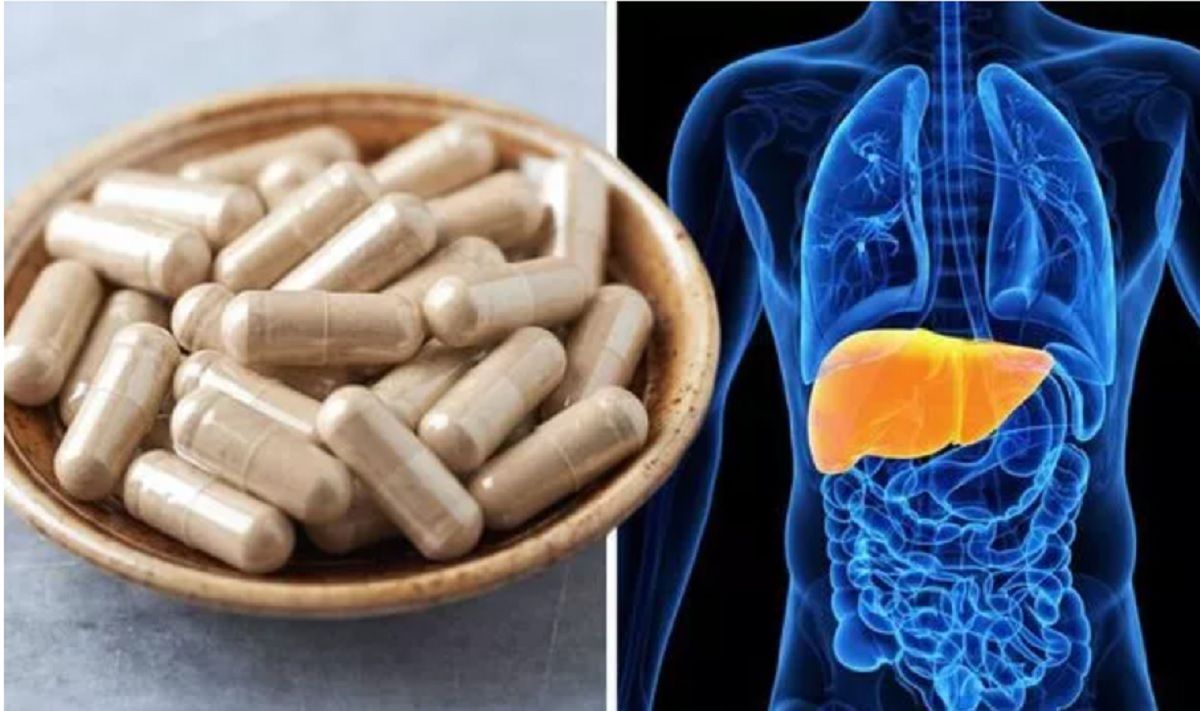
„Au fost raportate creşteri severe ale enzimelor hepatice alanin aminotransferază (ALT) şi/sau aspartat aminotransferază (AST) (>10x limita superioară a normalului) cu creşteri concomitente ale bilirubinei şi/sau fosfatazei alcaline (ALP) la femeile care iau medicamentul. În unele cazuri, testele funcţiei hepatice (LFT) crescute au fost asociate cu semne sau simptome sugestive pentru leziuni hepatice, cum ar fi oboseală, prurit, icter, urină închisă la culoare, scăderea apetitului sau dureri abdominale”, se arată în comunicatul EMA.
Recomandările PRAC
PRAC recomandă ca testele funcţiei hepatice să fie efectuate înainte de începerea tratamentului. În timpul primelor trei luni de tratament, trebuie efectuate LFT lunar, iar ulterior pe baza deciziei clinice. În timpul tratamentului, trebuie efectuate LFT dacă apar simptome sugestive de leziuni hepatice. Monitorizarea funcţiei hepatice trebuie menţinută până la normalizarea acestora, poitrivit noilor recomandări. Tratamentul trebuie întrerupt, potrivit PRAC în anumite cazuri de creşteri ale transaminazelor şi bilirubinei sau dacă creşterile enzimelor hepatice sunt însoţite de simptome sugestive de leziuni hepatice.
Rezumatul caracteristicilor produsului şi prospectul medicamentului sunt în curs de actualizare pentru a reflecta noile informaţii şi recomandări privind riscurile.
„După adoptare, o comunicare directă cu profesioniştii din domeniul asistenţei medicale (DHPC) pentru acest medicament va fi difuzat profesioniştilor din domeniul sănătăţii de către titularii autorizaţiei de introducere pe piaţă, în conformitate cu un plan de comunicare convenit, şi va fi publicat pe pagina de comunicare Direct cu profesioniştii din domeniul sănătăţii şi în registrele naţionale din statele membre ale Uniunii Europene”, a precizat EMA în comunicat.